Sacamos la bata de laboratorio, el matraz, las baterías y demás elementos del quimicefa para hablar sobre la electrólisis, este proceso químico en el cual se utiliza la corriente eléctrica para descomponer una sustancia en sus componentes básicos.
En un modo casero se entiende muy bien, pero si lo llevamos a nuestro mundo automovilístico: la electrólisis a menudo se relaciona con la generacióndehidrógeno a partir de agua. Este hidrógeno puede utilizarse como combustible en celdas de combustible para generar electricidad y alimentar el motor del automóvil, o también puede ser almacenado y utilizado de otras maneras.
Con una base teórica contada a modo de titulares, vamos a profundizar en este apasionante y químico tema que está encima de la mesa de varios fabricantes y que puede suponer el siguiente paso (o refuerzo) a lo que conocemos como coche de cero emisiones. Apuntad, que habrá examen sorpresa…
Proceso de electrólisis y sus componentes
La electrólisis, como sabéis, es un proceso electroquímico clave que requiere la interacción de tres elementos fundamentales: los electrodos, el electrolito y la corriente eléctrica que impulsa la reacción no espontánea. Por separado, cada elemento se especializa de la siguiente forma:
Electrodos: La unidad de electrólisis comprende dos electrodos y un electrolito, siendo los electrodos los conductores eléctricos que establecen contacto con la porción no metálica de un circuito. Estos elementos, conocidos como ánodo y cátodo, facilitan la transferencia de iones, posibilitando así la reacción química, los alumnos más aventajados podrán identificar:
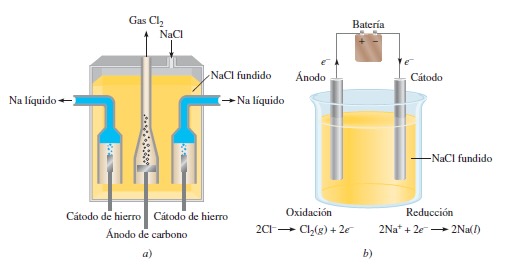
- El ánodo (+) es el electrodo que cede electrones, desencadenando una reacción de oxidación. Los materiales comúnmente empleados para fabricar ánodos incluyen compuestos de grafito natural en escamas, microesferas de carbono mesofase y grafito artificial derivado de coque de petróleo.
- El cátodo (-) es el electrodo que acepta los electrones provenientes del ánodo, dando lugar a una reacción de reducción. Los cátodos se construyen generalmente con diversos metales, siendo los más usuales el litio, el hierro, el aluminio, el cobalto y el manganeso.
Por su parte, el electrolito es cualquier sustancia que contiene iones libres, convirtiendo la sustancia en un conductor eléctrico, este palabro te sonará de ciertas bebidas deportivas y no vas mal encaminado. Desde un punto de vista práctico, el electrolito se presenta como una solución acuosa o salina en la que se sumergen los electrodos (ánodo y cátodo). La combinación de estos componentes constituye la célula de electrólisis, permitiendo la transferencia de iones entre el ánodo y el cátodo cuando se aplica una corriente eléctrica.
Tipos de electrólisis
Entendido el proceso, vamos ahora con los diferentes tipos que podemos encontrar:
Electrólisis del agua por electrodos: Este método implica la descomposición del agua (H₂O) en oxígeno (O₂) e hidrógeno (H₂) mediante el uso de corriente eléctrica. Los electrodos (ánodo y cátodo) se sumergen en agua y se aplica una corriente eléctrica. En el ánodo, se produce la oxidación del agua, liberando oxígeno, mientras que en el cátodo, se produce la reducción, liberando hidrógeno. La reacción química global es: 2H₂O → 2H₂ + O₂.
Electrólisis alcalina: Aquí, la electrólisis se realiza en una solución alcalina, generalmente con hidróxido de sodio (NaOH). Aquí, se utilizan electrodos de níquel o acero recubiertos con materiales catalíticos, y la reacción global es similar a la electrólisis del agua. Este enfoque a menudo se emplea para la producción industrial de hidrógeno.
Electrólisis de Membrana de Intercambio de Protones (PEM): En este tipo de electrólisis, se utiliza una membrana de intercambio de protones como separador entre el ánodo y el cátodo. La membrana permite que los protones se muevan hacia el cátodo mientras bloquea el paso de los electrones, forzándolos a seguir un camino externo, generando así corriente eléctrica. Este método se asocia comúnmente con celdas de combustible.
Electrólisis de Óxidos Sólidos (SOEC): la electrólisis realiza a altas temperaturas utilizando óxidos sólidos como electrolitos. Los materiales cerámicos conductores iónicos permiten la transferencia de oxígeno a través de la célula, donde puede ocurrir la descomposición del agua en oxígeno e hidrógeno.
Electrólisis de sales fundidas: por último en este método, se utiliza una sal fundida como electrolito en lugar de una solución acuosa. La alta temperatura facilita la conducción de iones y permite la electrólisis de diversas sustancias, incluidos los metales.
La electrólisis aplicada al sector automotriz
La electrólisis, en el contexto de vehículos, encuentra aplicaciones principalmente en la generación de hidrógeno como combustible para celdas de combustible. Pero vamos a ampliar esta afirmación y a centrar el tiro en las celdas de combustible para vehículos (FCV):
La electrólisis se utiliza para producir hidrógeno, y este hidrógeno se puede emplear en celdas de combustible instaladas en vehículos. En un vehículo de celdas de combustible, el hidrógeno se combina con oxígeno del aire en la celda de combustible para generar electricidad y agua como subproductos.
La electricidad generada alimenta el motor eléctrico del vehículo, proporcionando una alternativa de propulsión limpia y eficiente.
Como ya sabemos, los vehículos impulsados por celdas de combustible constan de una serie de ventajas VS los coches térmicos. Lo primero es que son coches con cero emisiones locales ya que la única emisión directa de un vehículo de celdas de combustible es agua, lo que contribuye a la reducción de la contaminación local.
Por otro lado, podemos tener mayor autonomía, estos vehículos de celdas de combustible pueden ofrecer una mayor autonomía en comparación con algunos vehículos eléctricos basados en baterías. Por último en materia de recargas rápidas, tenemos que mencionar que la recarga de hidrógeno puede ser más rápida que la recarga de baterías en algunos casos.
Claves para un futuro FCV
Como toda nueva tecnología, encontramos los mismos problemas iniciales. El primero es la infraestructura de recarga, por el momento (2024), con una red muy básica y con una disponibilidad de estaciones inferior a las de carga eléctrica.
Por otro lado existe la eficiencia de conversión, esto significa que a pesar de que las celdas de combustible son eficientes, la producción de hidrógeno mediante electrólisis puede suponer en estos estados iniciales pérdidas energéticas, especialmente si la electricidad utilizada no proviene de fuentes renovables.
Por contextualizar, este inconveniente que radica en las pérdidas durante la electrólisis supone que la eficiencia de toda la cadena energética, desde la generación de electricidad hasta el funcionamiento del vehículo, es sólo la mitad de la de un vehículo eléctrico de batería (BEV). No obstante, al considerar el ciclo de vida completo de los vehículos de pila de combustible (FCEV) y los BEV, las diferencias se reducen considerablemente.
Por otro lado, la investigación y desarrollos continuos de varios fabricantes se están centrando en cómo solventar primero el segundo de los problemas para mejorar la eficiencia de las celdas de combustible y reducir los costos asociados con la producción y utilización del hidrógeno.
Sobre el impacto medioambiental tenemos que responder a la siguiente pregunta: ¿En qué medida la propulsión mediante hidrógeno es sostenible y respetuosa con el medio ambiente? Un escenario deseado, desde una perspectiva medioambiental, sería que un vehículo funcione exclusivamente con energías renovables, sin generar emisiones nocivas. El caso de los vehículos de pila de combustible se acerca más a este precepto que los demás vehículos con otro tipo de propulsión.
Hablando en términos legales, los sistemas de propulsión alternativos deben reducir las emisiones de contaminantes, especialmente las de CO2 que afectan al clima, así como los gases perjudiciales para la salud, como los óxidos de nitrógeno. Los vehículos de hidrógeno emiten únicamente vapor de agua en sus gases de escape, lo que implica que la propulsión por pila de combustible no contribuye a emisiones locales, manteniendo el aire de las ciudades limpio.
Por último tenemos que hablar de cómo los fabricantes y proveedores se las ingenian para proteger al clima. En este sentido, todo depende de las condiciones de producción del hidrógeno, ya que la fabricación requiere energía eléctrica para llevar a cabo el proceso de electrólisis, descomponiendo el agua en hidrógeno y oxígeno.
Si la electricidad proviene de fuentes de energía renovable, la producción de hidrógeno no deja huella de carbono. Sin embargo, si se utilizan combustibles fósiles, el vehículo de hidrógeno puede tener un impacto negativo en el clima, que variará según el «mix energético» empleado.
Dentro de estos «ingenios» de como ser lo más eficientes posibles tenemos los factores que afectan directamente a la producción y a su transporte final. El hidrógeno puede producirse aprovechando excesos de electricidad renovable, siendo un subproducto en procesos industriales.
La propulsión por pila de combustible ofrece oportunidades para reciclar este hidrógeno, especialmente cuando se genera como residuo en procesos industriales. La producción de hidrógeno azul, a partir de combustibles fósiles con captura y almacenamiento de carbono, cosa que también es una opción. El transporte y almacenamiento del hidrógeno afectan el balance energético de los vehículos de pila de combustible.
Aunque más complejos y energéticamente intensivos que la gasolina o el diésel, el hidrógeno puede generarse localmente donde haya electricidad y agua. Con una infraestructura más desarrollada, las rutas de transporte podrían acortarse significativamente en el futuro y por ende, que los futuros usuarios de este combustible vean unos precios razonables en el cómputo total de tener un vehículo FCV.
Fuente: Hyundai, Toyota, BMW Innovation y diversos blogs sobre energía.